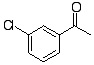
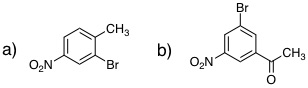
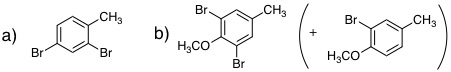
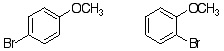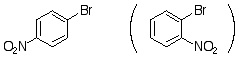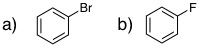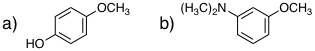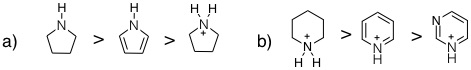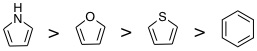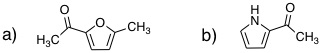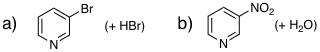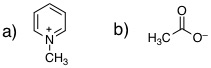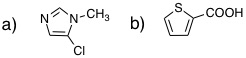有機反応化学IV(3年生科目)小テスト
08-01
|
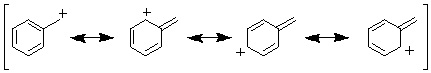
08-02 仮想的な1,3,5-cyclohexatrieneの水素化熱H1(kcal/mol)= (-28.6 x 3) - (-2.3 x 3) = -78.9<br/> 共鳴安定化エネルギーの大きさ|dH| = 29.1 kcal/mol |
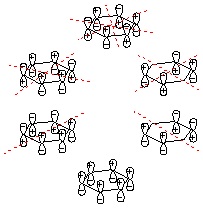
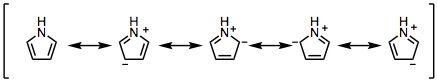
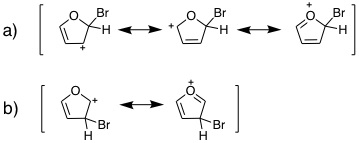
08-03 (例)構造式は講義ハンドアウト(または教科書)を参照。 五員環のsp2炭素上に電子1つを含むp軌道が4つ、電子2つを含むp軌道が1つあり(ヒュッケル則、環状、平面)、これらのp軌道がすべてπ結合性相互作用ができるため(完全共役に相当)。 |
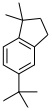
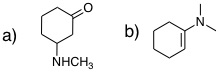
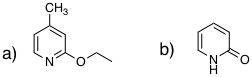
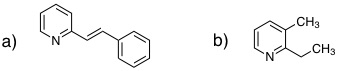
08-04 (a) 9-methylphenanthrene、(b)4-methylquinoline |
08-05
カルボニルが分極した状態を考えると、環状部分は芳香族の条件を満たすので、芳香族性があると考えられる。 |
08-06 (例)π電子の分子軌道を考える。 反芳香族では、環状に共役したπ電子の非結合性軌道(安定化に寄与しない)に電子を含む。 |
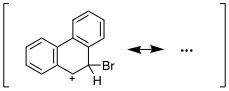
08-07
|
08-08
|
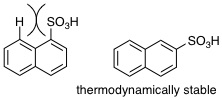
08-09 芳香族 |
08-10 非芳香族。環の内側に向いているC-H結合の水素原子が立体障害となって平面構造とならない。 |
19-01 (左から)methoxybenzene (anisole)、ethenylbenzene (styrene)、benzonitrile、1,4-dimethylbenzene |
19-02 (左から)1,2,4-trimethylbenzene、2-fluoro-1-methyl-3-nitrobenzene、3,5-dimethylbenzenecarboxylic acid (3,5-dimethylbenzoic acid) |
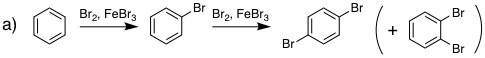
19-03 a) FeBr3あるいはAlBr3、b) HNO3 |
19-04 a) SO3H+(sulfonium ion)、b) H+(proton) |
19-05 (例)ルイス酸触媒は、ルイス塩基性をもつ塩素分子と反応し複合体を形成することで塩素の求電子性を高め、反応の活性化エネルギーを低下させる。 |
19-06
アシリウムイオン(アシリウムカチオン) |
19-07
|
19-08
|
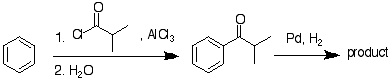
19-09
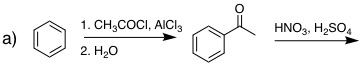
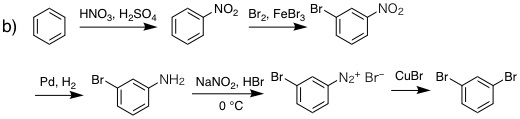
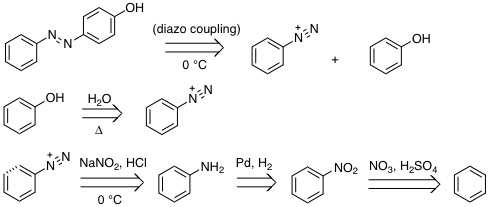
(還元法はClemmensen還元など他の方法でもよい) |
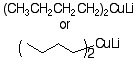
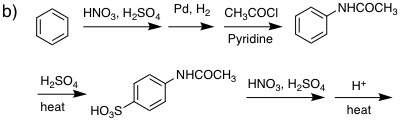
19-10 反応剤:
副生物:
|
19-11
|
19-12
|
19-13
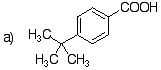
4-(1,1-dimethylethyl)benzoic acid(第3級アルキル基の場合、ベンジル位炭素は酸化されない。) |
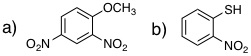
19-14 a) トルエン (メチルベンゼン:メチル基は活性化基) |
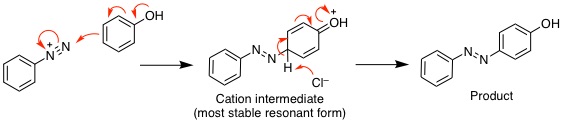
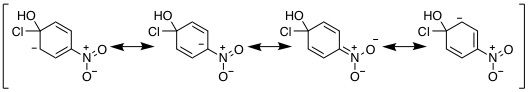
19-15 (例)メトキシベンゼンのカチオン中間体は置換基酸素にカチオンが分布する共鳴極限構造式がかけ、ベンゼンより共鳴構造が多く安定化するので、律速段階となる活性化エネルギーも低下し反応速度が大きくなる。 |
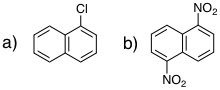
19-16 c)とd) |
19-17
|
19-18
|
19-19
|
19-20 a) 小さい(酸性度が高い)、b) 大きい(酸性度が低い) |
19-21 a) オルト体, b) パラ体, c) パラ体 |
19-22
|
19-23
|
19-24
|
19-25
|
19-26
|
19-27
|
19-28
|
19-29
|
19-30
|
19-31
|
19-32
|
19-33
|
19-34
|
19-35
|
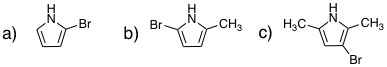
20-01 a) pyrrolidne, b) aziridine, c) azetidine, d) azepane (体系名azacycloheptane) |
20-02 a) tetrahydrofuran, b) thiirane, c) oxetane, d) 1,4-dioxane |
20-03 a) furan, b) thiophene, c) pyrrole, d) pyridine |
20-04
|
20-05
|
20-06
|
20-07
|
20-08
|
20-09
|
20-10
|
20-11
|
20-12
|
20-13
|
20-14
|
20-15
|