研究背景と概要
分子生物学の中心原理であるセントラルドグマにおいて遺伝情報であるmRNAがタンパク質に翻訳された後、 何を引き金として分解されているのかという点については不明でした。 私達は、翻訳の最終段階である翻訳終結がmRNA分解をひきおこすトリガーであることを明らかにしました。 翻訳が終わってタンパク質ができてしまえば、元の情報は不要なわけですが、 まさに翻訳を終えたというシグナルがmRNA分解を引き起こすシグナルとなっていることをはじめて示しました。
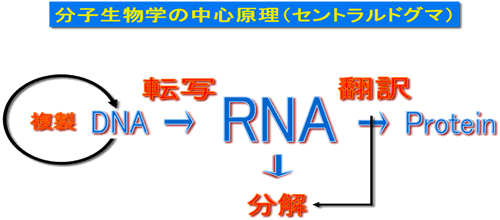
私達は酵母の遺伝学を用いた解析から、 翻訳終結因子eRF3が翻訳終結と共役してmRNA分解の律速段階である3’末端ポリA鎖の 短縮化(デアデニレーション)を制御していることを見出しました。 このような機構はヒトにおいても保存されています。私達はその分子機構について解析し、 以下のような『mRNA分解開始の分子機構』を明らかにしました(Funakoshi et al., Genes Dev 2007)。
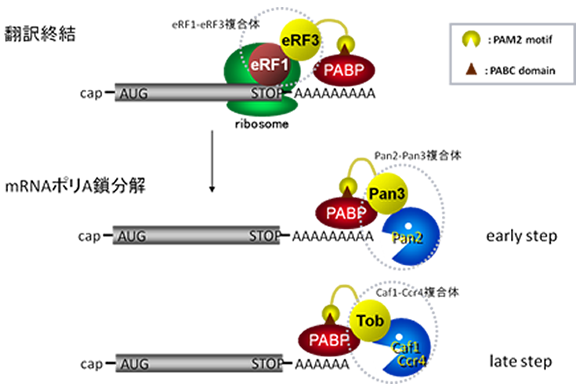
翻訳終結を制御する翻訳終結因子複合体eRF1-eRF3と mRNA 3’末端ポリA鎖を分解する2つのポリA鎖分解酵素複合体Pan2-Pan3およびCaf1-Ccr4は構造的には全く無関係な因子ですが、 共通してPAM2モチーフというアミノ酸配列をもちます。 これはmRNAの3’末端ポリA鎖に特異的に結合するポリA鎖結合タンパク質PABPとの結合モチーフであり、 この3つの複合体はPABPに対して競合的に結合します。 eRF1-eRF3はPABPと会合した状態で存在しますが、翻訳終結に伴ってPABPから解離し、 それに代わってPan2-Pan3、Caf1-Ccr4がPABPと競合的に結合します。 これらポリA鎖分解酵素はPABPと会合することで活性化し、ポリA鎖の分解を引き起こすわけです。
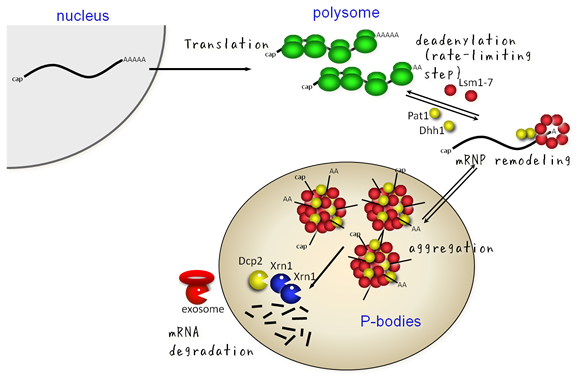
図3には、mRNAの一生を示しています。 mRNAは核における転写とスプライシングを経て成熟し、 成熟型mRNAが核外に輸送されて細胞質においてリボソームによる翻訳をうけます。 翻訳に伴ってmRNAの3’末端ポリA鎖は徐々に短縮化され、 約10塩基程度になった時点でLsm-Pat1複合体やDhh1といったRNA結合タンパク質がmRNA 3’末端に会合し、 mRNPのリモデリングがおこります。 このようなmRNAは凝集体を形成して細胞内の顆粒状構造であるPボディに取り込まれ、 顆粒中に存在するDcp1/2、Xrn1などのRNA分解酵素によって主として5’→3’方向に分解をうけます。 ここで重要な点は、mRNA分解の律速段階が第一段階のポリA鎖の短縮化過程にあるということで、 いったんポリA鎖が分解されてしまえばあとはmRNA本体が一気にこわされてしまうということです。 ポリA鎖が翻訳に伴って徐々に短縮化されることは知られていたわけですが、 まさにこの「mRNA分解開始」過程で先に示した図2のような機構がはたらいていることを私達が明らかにしました (Funakoshi et al., Genes Dev 2007)。
以上の研究成果を踏まえて、現在以下のような研究課題が当研究室において進行中です。
研究課題
[1] mRNA分解開始過程(mRNA 3’末端ポリA鎖)を標的とした新しい遺伝子発現制御の分子機構
mRNAにはその寿命を規定するシス因子が3’UTRに存在することが知られています。
最も代表的なものがmRNAを不安定化するARE (AU-rich element)、
逆にmRNAを安定化するPRE (pyrimidine-rich element)です。
このようなシス因子はホルモンやストレスなどのシグナルによっても制御されており、
主としてポリA鎖の分解調節を介してmRNAの安定性を規定していると考えられていますが不明な点が多く残されています。
また、最近ではマイクロRNA (miRNA)も3’UTRに結合しポリA鎖を調節することで遺伝子発現を制御していることが明らかになってきました。
これらのシス、トランスの因子がどのようにしてポリA鎖を調節し遺伝子発現を制御しているのかについて解析を行なっています。
一方、このようなポリA鎖短縮化の調節に対して、ポリA鎖伸長による調節が知られています。
主として、卵成熟や胚発生などの発生の初期過程において、
mRNAは細胞質でポリA鎖のない翻訳不活性な状態で保存され、
必要に応じてポリA鎖伸長を起こして遺伝子発現をオンにします。
このような細胞質ポリA鎖伸長反応は体細胞においてもおこることが最近になって明らかになってきました。
このようなポリA鎖の短縮化と伸長は拮抗的にはたらき、
遺伝子発現のより高度な調節を可能にしていると考えられ、
これらを包括的に理解することが私達の最終的な目標です。
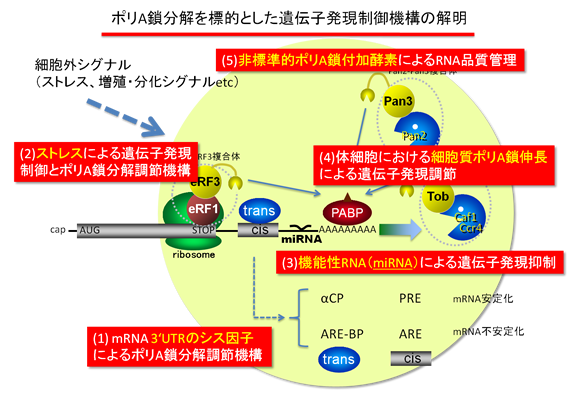
[2] 異常なmRNAを分解するmRNA品質管理機構の解明
上述のように、私達は正常なmRNAのその分解開始機構について分子機構を解析してきました。
その一方で、異常なmRNAを分解する機構がこれとは別に存在します。
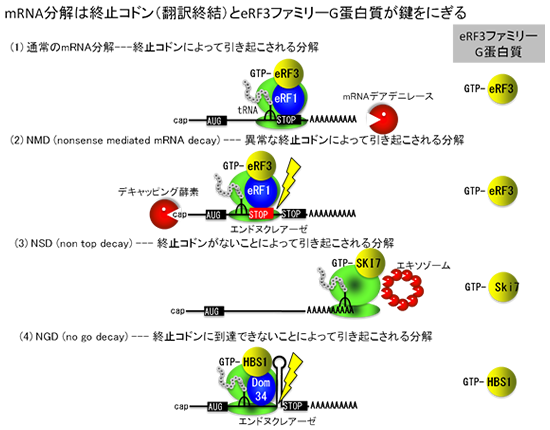
ナンセンス変異をもつ異常なmRNAはナンセンス変異型mRNA分解(NMD; nonsense-mediated mRNA decay)によって分解されます。
この場合、ナンセンス変異はmRNAのORF (open reading frame)中に挿入された終止コドン(PTC; premature termination codon)ですから、
この場合においても翻訳終結因子複合体eRF1-eRF3がそのナンセンス変異の認識において機能します。
ところが、この場合には正常なmRNAの場合と異なりポリA鎖分解よりは5’キャップ構造の切断や
エンドヌクレアーゼによる切断が主要な経路として進行します。
また、終止コドンのない異常なmRNAは、ノンストップ型mRNA分解 (NSD; nonstop decay)によりmRNAが分解されます。
この場合終止コドンがないため、リボソームはmRNAの3’末端まで翻訳したところでストールし、
そこに翻訳終結因子eRF3の相同因子Ski7が3’→5’方向の分解を触媒するエキソソームとともに結合して主に3’→5’方向の分解を引き起こします。
さらに、リボソームが翻訳途中にストールするような二次構造をもつ異常なmRNAの場合には、
リボソーム停滞型mRNA分解 (NGD; no go decay)により分解されます。
この場合には、異常な二次構造によりリボソームが終止コドンまで到達できず途中でストールし、
そこへやはりeRF3の相同因子HBS1がeRF1の相同因子DOM34を連れて結合します。
これらの結合により、mRNAはエンドヌクレアーゼによる切断反応をうけることが報告されていますが、
その実体や分子機構の詳細については明らかにされていません。私達は現在これらの機構についても解析を行なっています。
私達はこれまで、正常なmRNAの分解制御にeRF3が機能していることを明らかにしてきましたが、
NMD、NSD、NGDといった異常なmRNAの分解においても
eRF3ファミリーに属するGタンパク質が重要な役割をはたしていることが明らかになってきており、
これらeRF3ファミリーGタンパク質によるmRNA分解の普遍的制御機構について解明することを目指しています。
[3] RNAの細胞内動態制御
先述の通り、mRNAは成熟化に伴って核外へと輸送され、 細胞質において翻訳と共役したポリA鎖の分解をうけた後、 細胞内の顆粒状構造であるPボディ(PBs; Processing Bodies)へと移動することでその局在を大きく変化させます。 また一方で、ストレス時においては翻訳開始因子eIF2のリン酸化を介してmRNAは翻訳を停止し、 このようなmRNAはもう一つの細胞内顆粒状構造であるストレス顆粒(SGs; Stress Granules)へと移動します。 そして、ストレスが消去されるまでストレス顆粒の中に保存されます。 このようなmRNAの細胞内顆粒状構造への移行は、mRNA 3’末端ポリA鎖の調節と密接な関係があることが指摘されており、 ポリA鎖の調節がmRNAの細胞内動態を制御する分子メカニズムの解明を目的として研究を進めています。
[4] RNA代謝と疾患
RNA代謝に関わる因子が疾患原因遺伝子としてはたらく例が数多く報告されています。 私が発見したeRF3の主要なサブタイプであるGSPT1にはグリシンをコードするGGCの繰り返し配列が存在します。 健常人ではこの繰り返しが10前後であるのに対し、 12以上のヒトでは胃がんや乳がん、大腸がんなど癌の発症リスクが増大することが明らかになってきました。 また、脊髄小脳変性症II型は運動失調を主症状とする神経変性疾患であり現段階では根本的な治療法のない疾患ですが、 この原因遺伝子Ataxin-2はmRNA代謝に関わることがごく最近わかってきました。 Ataxin-2にはグルタミンをコードするCAGの繰り返し配列があり、 この配列の異常伸長が脊髄小脳変性症を引き起こします。 この両者に共通することはトリプレットコドンの伸長によって疾患が発症するということであり、 このような疾患をトリプレットリピート病と呼びます。 RNA代謝の制御因子にはこのようなトリプレットリピート多型性を有する因子が数多く存在します。 私達は、最終的に疾患治療への応用を目標に、 トリプレットリピート伸長がこれらの因子の生理機能にどのような影響を与え疾患発症に至るのかを解析しています。
