Research
細胞内オルガネラの働きによる神経制御機構
1. 脂質蓄積による脳機能障害の原因メカニズム
近年アルツハイマー病やパーキンソン病などの神経変性疾患の原因として、脳における異常な脂質蓄積が知られています。しかしその脂質異常のメカニズムはよくわかっていませんでした。私たちはリポファジーという脂質分解系の不全が、脳内脂質の異常蓄積の原因であることを明らかにしました【Morita, et al, iScience, 2022】。
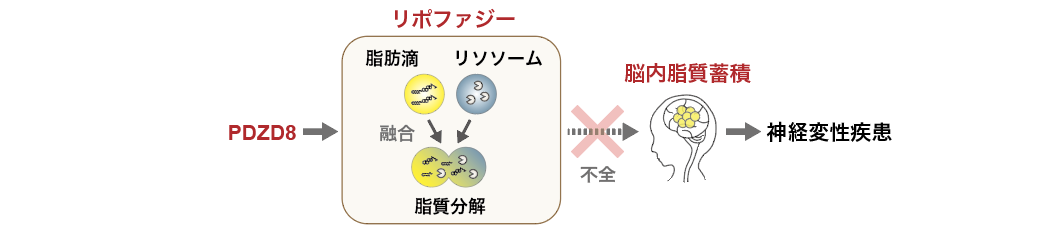
ヒトのPDZD8遺伝子の変異は、知的障害や認知機能障害と関係することが知られています。私たちは先行研究で、PDZD8タンパク質が細胞内脂質の輸送活性を有していること、それによりエンドソームやリソソームの成熟に働くことを見いだしていました(後述)。そこでPDZD8遺伝子欠損マウスを作製し、その組織のリピドーム解析を実施しました。その結果、野生型マウスと比べてPDZD8欠損マウスの脳ではコレステロールエステル(CE)が異常蓄積していることを発見しました。このCEの異常蓄積は脳に特異的で、肝臓の脂質は正常でした。また食餌とは無関係でした。またCE合成経路には異常ありませんでした。一方でPDZD8欠損マウスの脳やPDZD8発現抑制神経細胞において、脂肪滴とリソソームの融合やリソソーム成熟に遅延が認められ、リポファジーの不全が明らかになりました。よってPDZD8欠損マウスの脳では、リポファジー不全により脂質分解に不全を来し、CEが蓄積していると示唆されました。
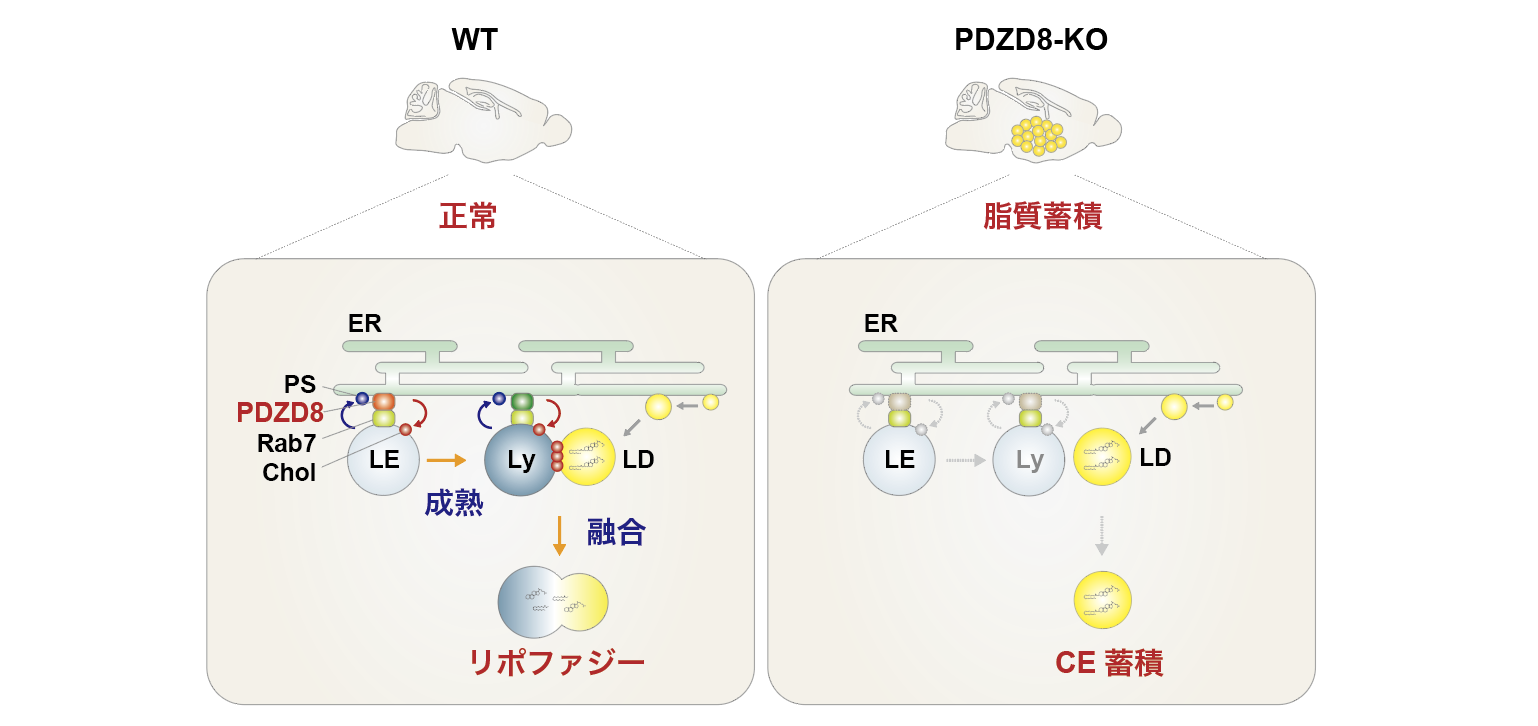
以上より神経変性疾患の原因のひとつである脳内脂質の異常蓄積がリポファジーの不全に起因すること、またPDZD8がその制御に中心的な役割を果たしていることが明らかになりました。そしてPDZD8は脂質分解の制御により脳内の脂質蓄積を抑制し、脳機能の維持に働いていると示唆されました。
2. 脂質輸送を介したエンドソーム成熟と神経健常性の維持
神経疾患や精神疾患の治療は大変難しいと言われています。その理由として、神経細胞は脆弱で、かつほとんど再生しないこと、また脳の神経細胞同士の繋がり(神経回路)が非常に複雑であることなどがあげられます。私たちは神経細胞が健常に保たれるしくみや、神経精神疾患の原因メカニズムを研究しています。そしてさまざまな神経精神疾患に共通する機構を、分子の言葉でできるだけシンプルに説明したいと思っています。
近年、神経精神疾患の原因機構として脂質の関与が示唆されています。例えば神経変性疾患のひとつであるアルツハイマー病の原因として、コレステロールの輸送や代謝の異常が報告されています。このような知見から神経細胞を健常に保つためには、神経細胞内で脂質が正常に代謝され分布することが重要だと考えられます。こうした背景から私たちは、神経精神疾患の原因機構のひとつとして脂質の輸送や代謝に注目しています。
細胞内における脂質の輸送や代謝は、細胞内オルガネラ(細胞内小器官)を介して行われます。例えば脂質は小胞体の中で水酸化やエステル化などの修飾を受けます。また脂質はエンドソームを介して輸送され、リソソーム内で分解されます。このように小胞体やエンドソームやリソソームは、脂質制御の場として働いています。またエンドソームやリソソームは膜接触部位と呼ばれる場所で小胞体とコミュニケーションをとっています。膜接触部位とは異なるオルガネラ同士が接している場所で、そこでは各オルガネラのアイデンティティを保ちつつ相互に分子情報が交換されており、近年その重要性が注目されています。
私たちは、この膜接触部位で小胞体からエンドソームに脂質が輸送され、その結果エンドソームの成熟が促進され、それが神経健常性の維持に繋がることを見出しました。エンドソーム成熟というのは、エンドソームとリソソームが融合することにより、エンドソームに含まれるタンパク質や脂質がリソソーム内の酵素によって分解されるという機構で、細胞の恒常性維持に重要な役割を果たしています。さらに私たちは神経変性の原因のひとつとして、このエンドソームの成熟不全を示しました【Shirane, et al, Nature Commun, 2020】。
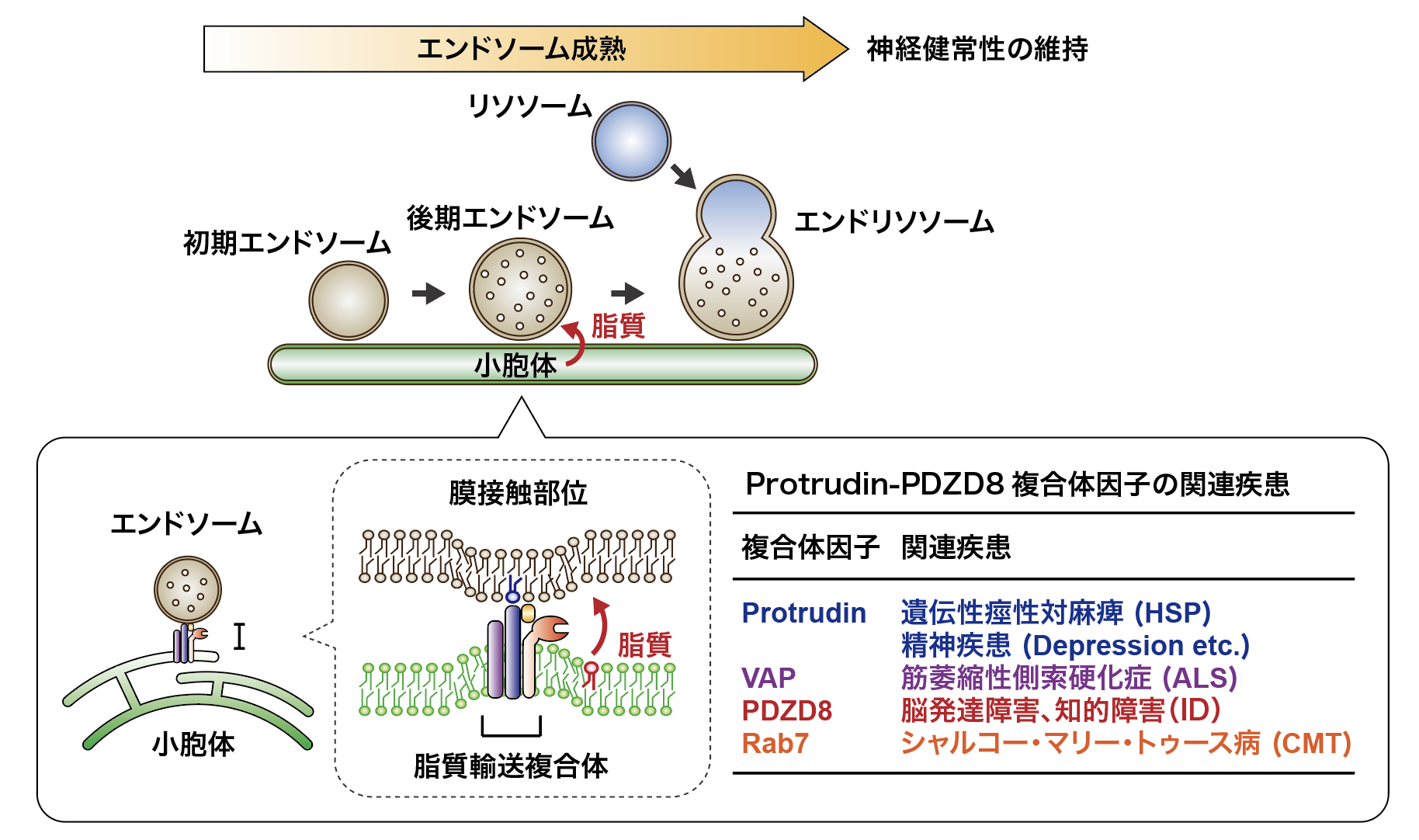
この発見のきっかけになったのは、プロトルーディンの結合タンパク質をプロテオミクスという方法で解析し、新規の脂質輸送複合体を同定したことです。この複合体にはさまざまな神経疾患や精神疾患の原因分子が含まれていたため、神経細胞の健常性維持に重要な働きをしている複合体であることが示唆されました。その構成因子と神経精神疾患の関係について、プロトルーディンは神経変性疾患のHSPやうつ病などの精神疾患と関連し、VAPは筋萎縮性側索硬化症(ALS)と関連し、PDZD8は脳発達障害に起因する知的障害(ID)と関連し、Rab7は神経変性疾患のCMTと関連しています。私たちはこの複合体に含まれるPDZD8が脂質輸送活性を持っていることを、世界に先駆けて証明しました。今後この新規脂質輸送複合体の詳細なメカニズムをさらに明らかにし、神経精神疾患の原因解明に繋げたいと考えています。
以上私たちの最新の研究についてご紹介しました。以下はこれまでの研究内容です。
3. 「膜接触部位」におけるオルガネラ間コミュニケーション
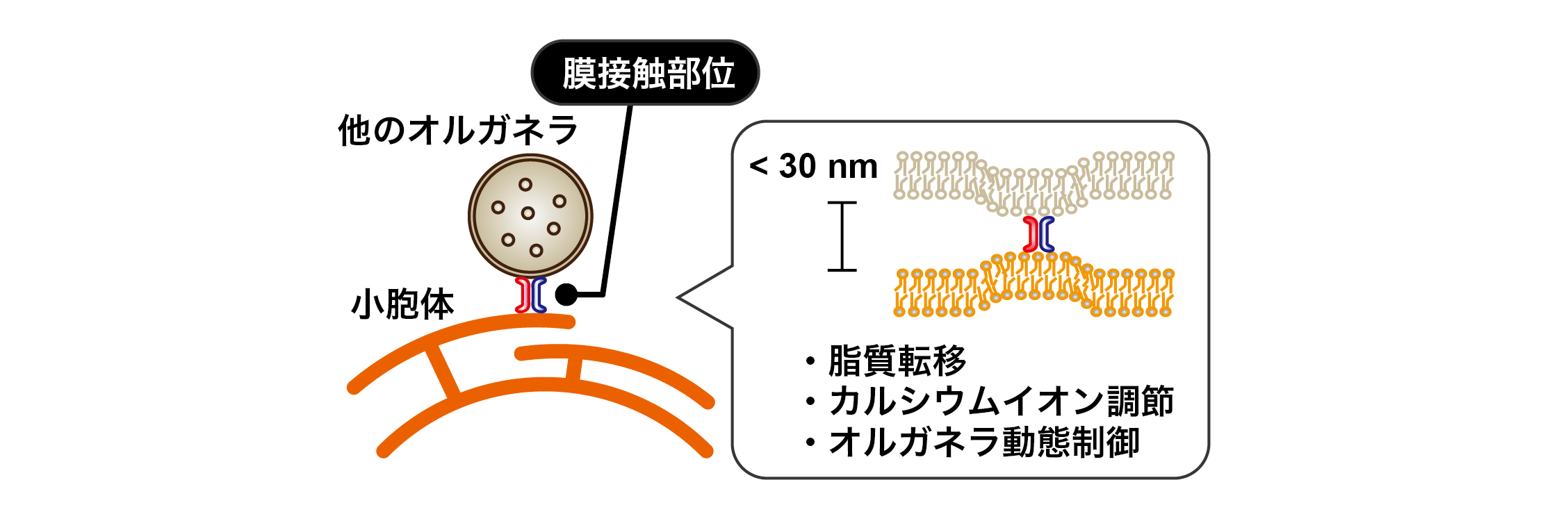
小胞体は細胞内最大の体積を占めるオルガネラで、細胞中に網の目状のネットワークを張り巡らせています。細胞内のさまざまなオルガネラ(ミトコンドリアやゴルジ体やエンドソームやリソソームや脂肪滴など)は小胞体ネットワークと接して存在しており、その接点で相互に物質交換や情報伝達を行っています。オルガネラ同士が接するこの特殊なマイクロドメインは、「膜接触部位」(Membrane contact sites、MCSs)と呼ばれています。
これまで個々のオルガネラの独立した機能が多く解析されてきましたが、最近は膜接触部位におけるオルガネラ間コミュニケーションの重要性に注目が集まっています。膜接触部位では、オルガネラ同士が膜融合することなく30 nm以下という近距離で並置しており、各オルガネラのアイデンティティーを維持しつつ接しています。膜接触部位の代表的な働きとして、(1)脂質の転移や代謝、(2)細胞内カルシウムイオン調節、(3)オルガネラ動態制御が知られています。例えばリン脂質やコレステロールなどの脂質は、小胞体と他のオルガネラ(ミトコンドリアなど)との膜接触部位で転移を介して代謝や合成が進みます。また細胞内カルシウムイオンの濃度は、小胞体と他のオルガネラ(形質膜やミトコンドリアやリソソームなど)との膜接触部位で、シグナル依存的に調節されます。またエンドソームの移動やミトコンドリアの分裂も、膜接触部位で制御されています。このように異なるオルガネラ同士が互いにコミュニケーションをとり協調的に働くことで、細胞内ホメオスタシスが維持されています。
この膜接触部位の存在は50年以上も前から知られていましたが、研究手法の難しさから、長年不明な点が多く残されていました。ところが近年、膜接触部位の繋留タンパク質の発見や光学技術の発達などにより、急速にこの研究領域が進展しています。
4. 膜接触部位の繋留タンパク質「プロトルーディン」によるエンドソーム輸送の制御
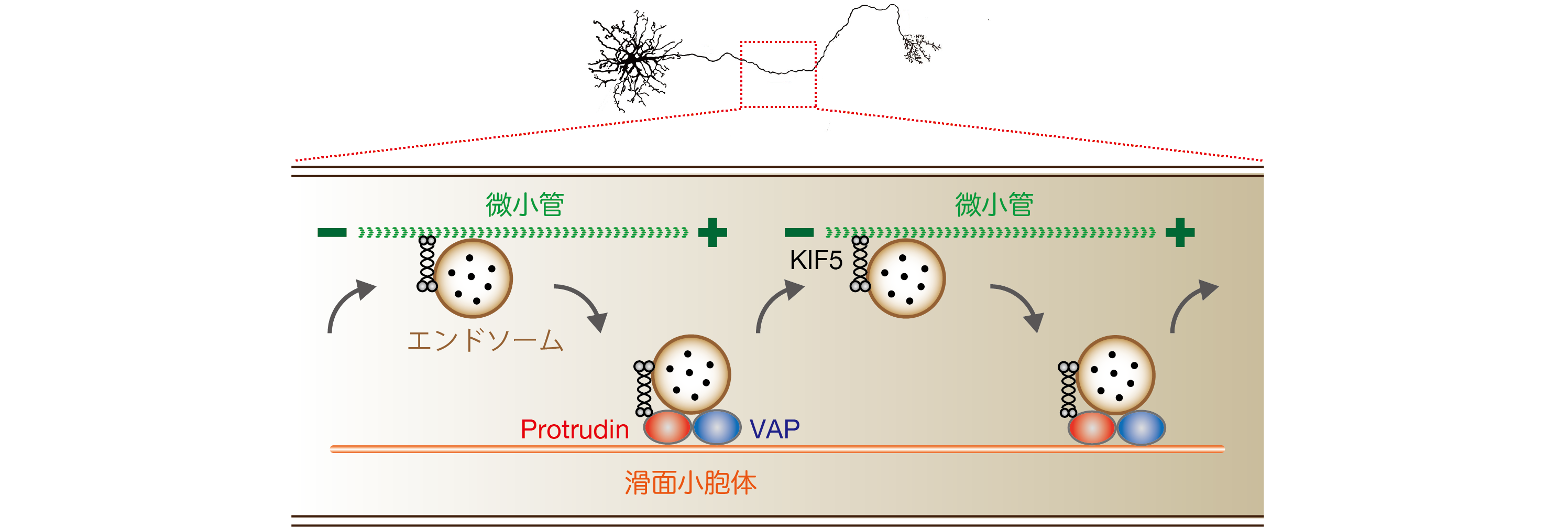
私たちは神経系を中心とした細胞内オルガネラの機能や機構を研究しています。Protrudin(プロトルーディン、遺伝子名ZFYVE27)は私たちが発見した細胞内輸送の制御タンパク質で【Shirane and Nakayama, Science, 2006】、低分子量Gタンパク質Rab11と結合し、微小管に沿った細胞内の極性輸送の促進に働きます。これをサポートする機構として、プロトルーディンが微小管モータータンパク質KIF5と複合体を形成していることを見出しました【Matsuzaki, et al, Mol Biol Cell, 2011】。KIF5は微小管のマイナス端からプラス端方向へエンドソームを運ぶモーター分子で、プロトルーディンと共に極性輸送の促進に働きます。
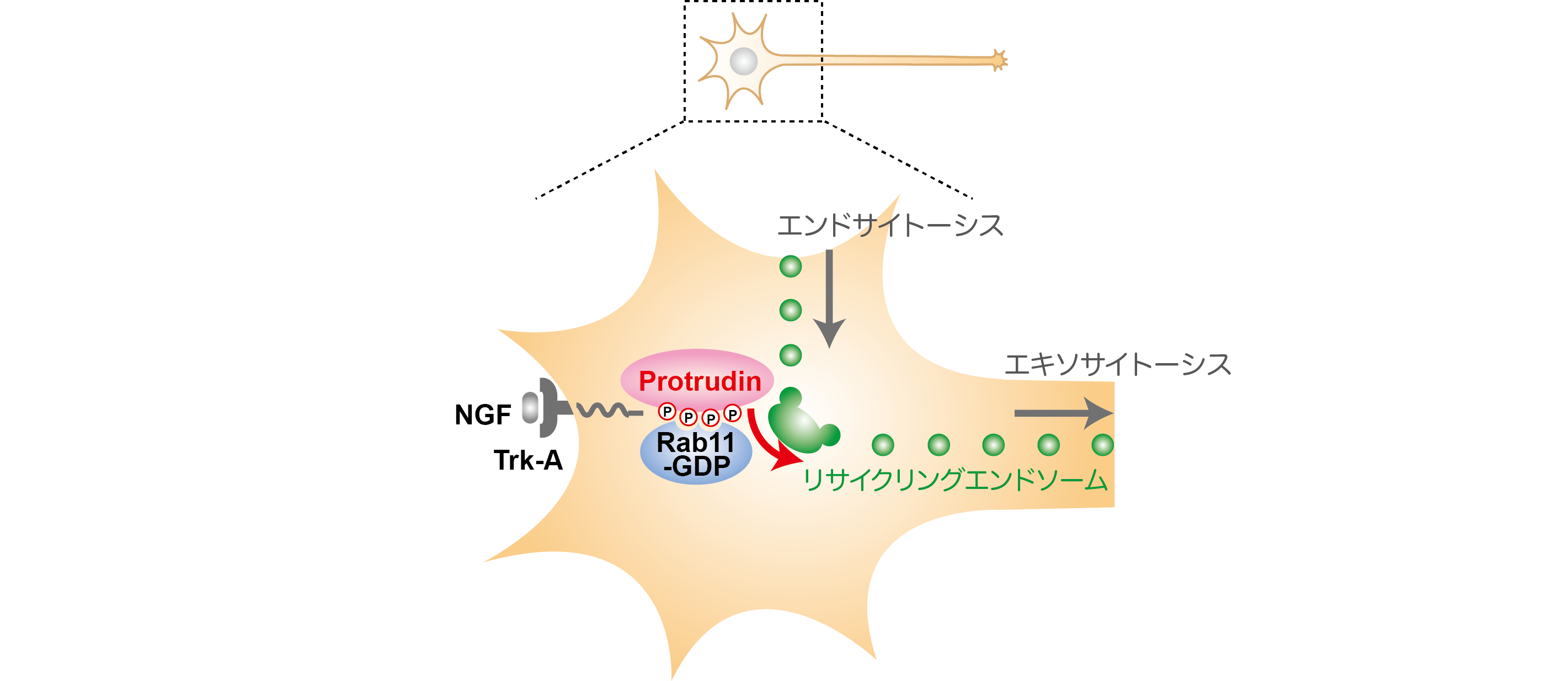
またプロトルーディンが膜接触部位の足場タンパク質VAPと結合していることを見出していましたが【Saita, et al, J Biol Chem, 2009】、近年プロトルーディンが膜接触部位において中心的な役割を果たしていることが明らかになりました。プロトルーディンは、エンドソームを小胞体に繋留してKIF5を付与し、そのエンドソームを微小管へ受け渡す、という一連の動態を制御します。小胞体と微小管の間でこのエンドソームのピンポン運動が繰り返され、エンドソームの極性輸送が促進されます。このように、プロトルーディンは小胞体ーエンドソーム間膜接触部位における、オルガネラ動態制御のカギ分子です。
現在、膜接触部位の構成要素や作用機序や生理機能について、さらに理解すべく研究を展開しています。特に変異マウスの作製・解析を通して、個体における膜接触部位の生理機能や、疾患との関連の解明に取り組んでいます。【Shirane, Front Cell Dev Biol, 2020】
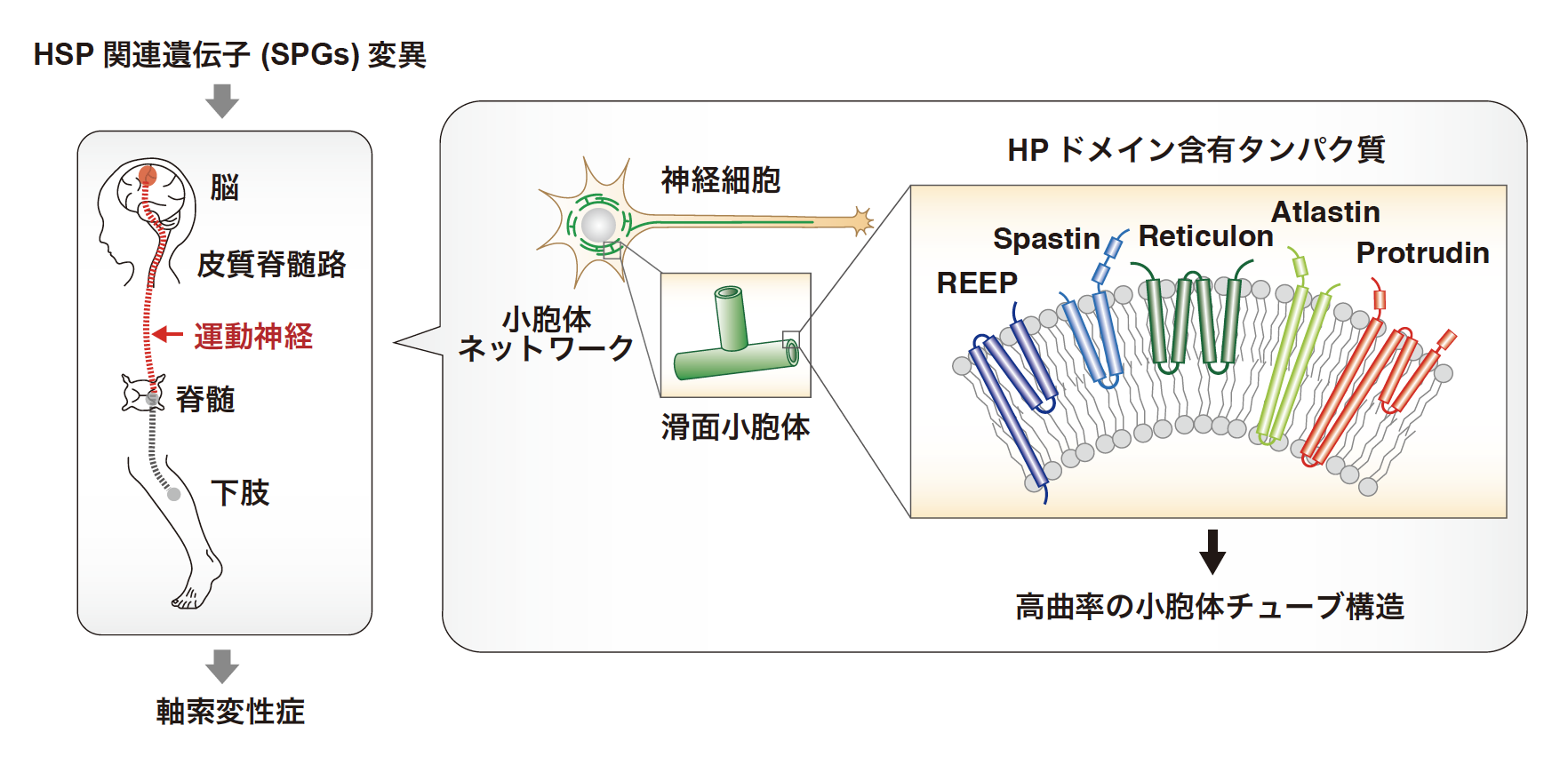
5. 神経変性疾患の病態機構
神経変性疾患とは神経細胞が変性(=死滅)する病気で、アルツハイマー病やパーキンソン病やALSなどが含まれます。私たちは神経変性疾患の発症原因の解明を目指しており、その一部の分子機構を明らかにしました。神経変性疾患の一種である遺伝性痙性対麻痺(Hereditary spastic paraplegia, HSP)の患者家系で、プロトルーディンの遺伝子変異が見つかっており、別名Spastic paraplegia geen 33 (SPG33)とも呼ばれています。以前よりプロトルーディンはHSP関連タンパク質spastinと結合していることが知られていましたが、私たちはプロトルーディンの神経特異的トランスジェニックマウスを作製し、その脳からプロテオミクス解析によりプロトルーディン複合体を同定し、プロトルーディンが複数のHSP関連タンパク質(Atlastin1, REEPs, Rtns, KIF5s, PLP2, etc.)と相互作用していることを見出しました。またプロトルーディンはヘアピン(HP)ドメインという膜曲率制御ドメインを持っていて小胞体の構造調節に関わっていること、そしてプロトルーディンの変異は小胞体ストレスを誘導し、その結果神経変性を引き起こすことも明らかにしました【Hashimoto, et al, J Biol Chem, 2014】。主要なHSP関連分子はプロトルーディンと同様にヘアピンドメインを持っており、このドメインは小胞体の構造制御に寄与しているため、小胞体の機能不全がHSPの発症に関連していると考えられます。
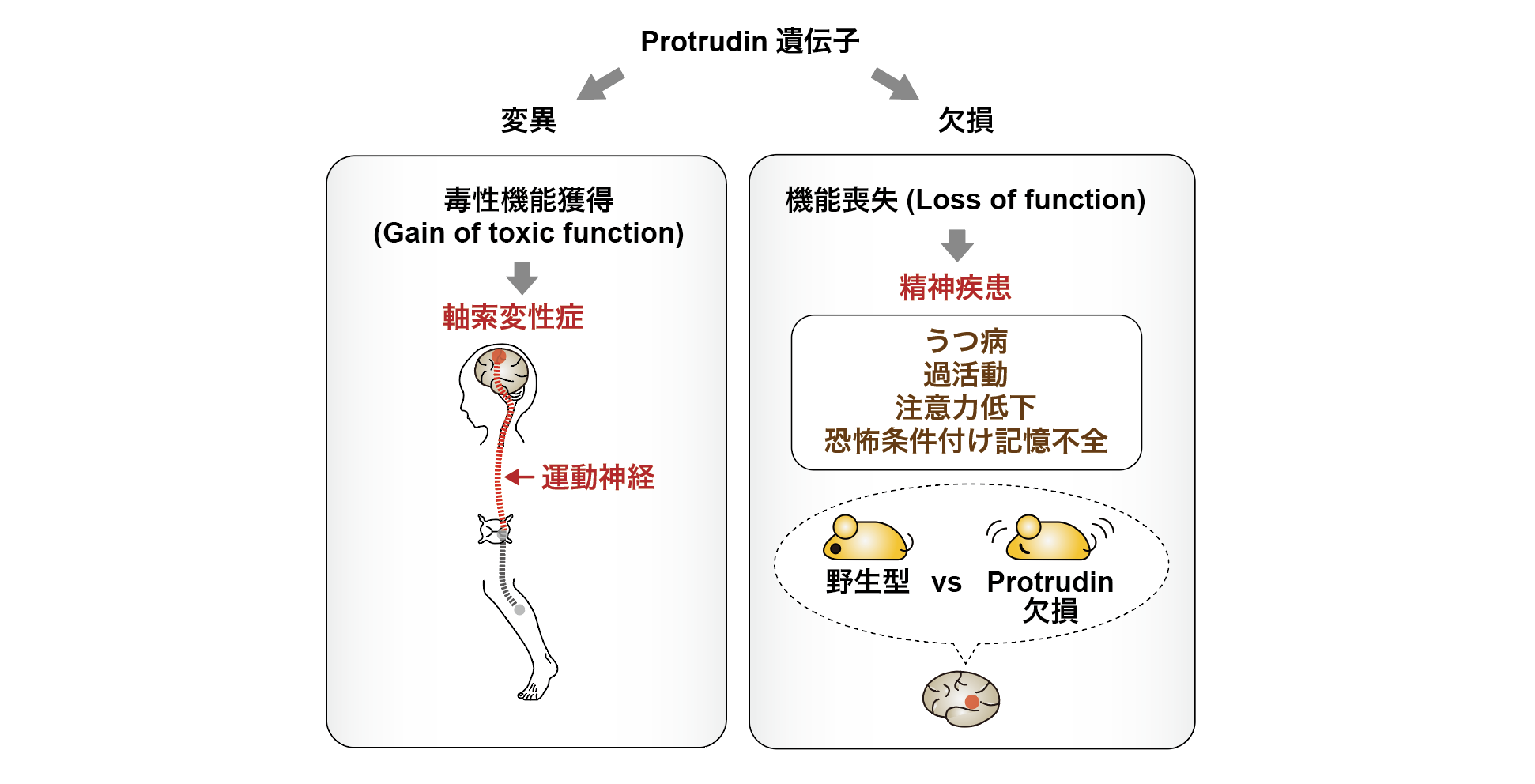
6. 精神疾患の病態機構
精神疾患には、統合失調症・気分障害(うつ病など)・不安障害(パニック障害や強迫神経症やPTSDなど)が含まれます。精神疾患の原因として、モノアミンの量的調節の不全などが示唆されていますが、詳細な機構はわかっていません。私たちはプロトルーディンの遺伝子欠損マウス(ノックアウトマウス)を作製して行動バッテリー解析を行ったところ、うつ病様の行動や、過活動や、注意力低下や、恐怖条件付け記憶の不全といった精神疾患様の表現型が認められました【Shirane et al, Mol Brain, 2020】。
これまでの知見より、ヒトのプロトルーディン遺伝子変異では毒性機能獲得(gain of toxic function)により軸索変性症を発症しますが、一方でマウスのプロトルーディン遺伝子欠損では機能喪失(loss of function)により精神疾患様の表現型を呈します。よってプロトルーディンは正常な神経の発生や行動に必須の役割を果たしていることが示唆されました。さらにプロトルーディン結合タンパク質のPDZD8もPTSDのリスク因子として報告されているため、プロトルーディン複合体と精神疾患の関連機構を明らかにすることは精神疾患の原因解明に繋がると期待されます。
7. 神経系の発生機構
胎生期の発生過程では、アポトーシス(細胞死)により組織が形成されることが知られています。われわれはアポトーシス制御タンパク質FKBP38を発見し、そのメカニズムを明らかにしました【Shirane and Nakayama, Nature Cell Biol, 2003】。FKBP38は、抗アポトーシス分子のBcl-2をミトコンドリアにリクルートし、アポトーシスを抑制します。さらにミトコンドリア損傷時には、FKBP38やBcl-2がマイトファジー(ミトコンドリアオートファジー)による分解から逃れ、小胞体に避難してアポトーシスに備えることを明らかにしました【Saita, et al, Nature commun, 2013】。
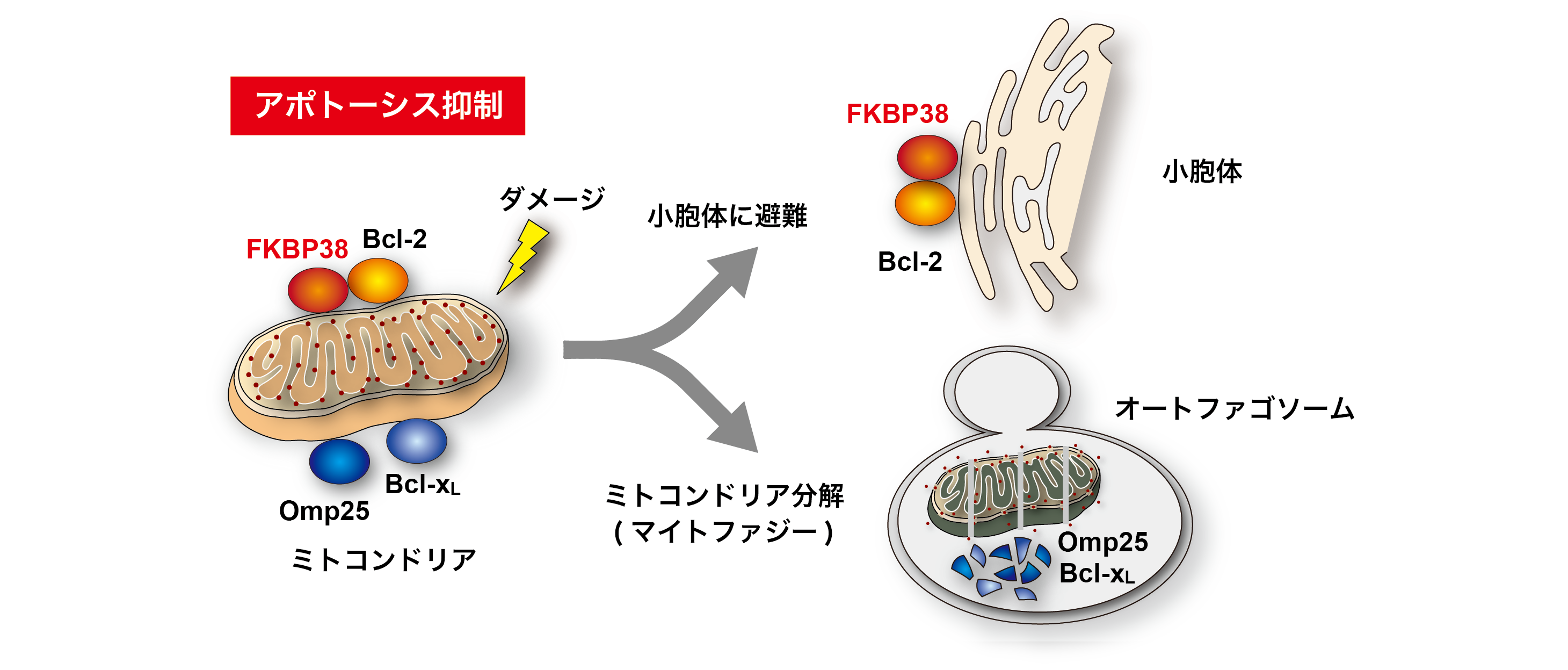
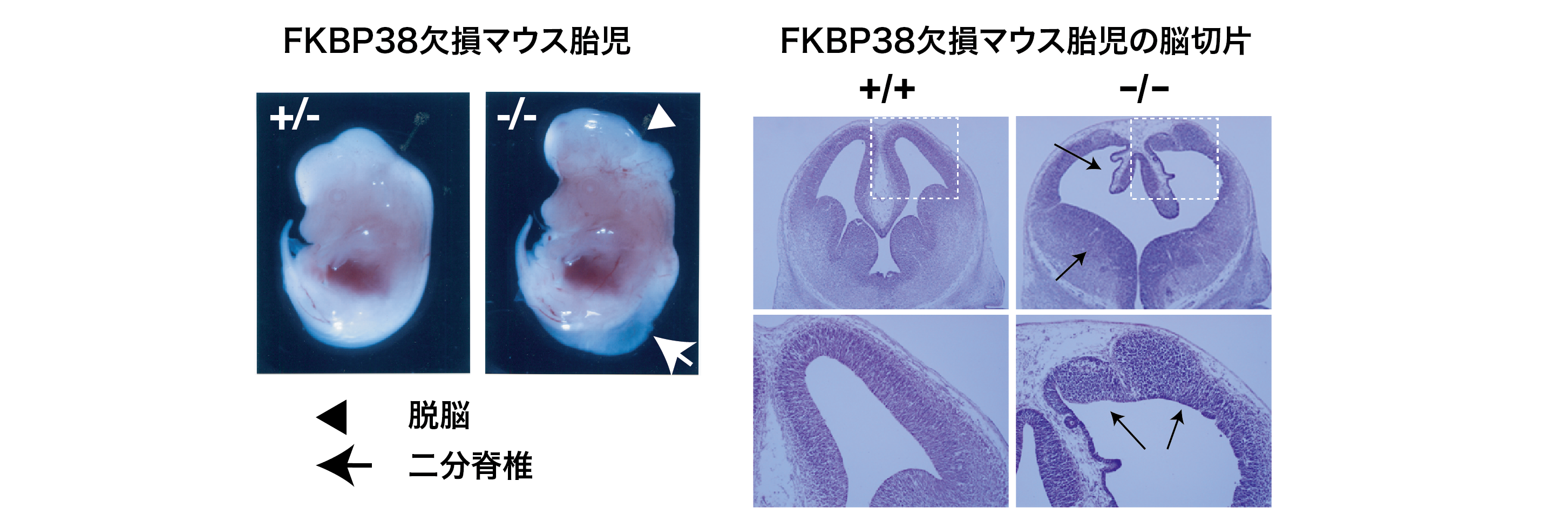
またFKBP38ノックアウトマウスを作製し、神経管の形成不全や、生直後に死亡することを見出し、その機構を明らかにしました【Shirane, et al, Genes Cells, 2008】。FKBP38はアポトーシス抑制作用の他、ソニックヘッジホッグ (SHH)シグナル制御にも重要な役割を果たしている、多機能のシャペロンタンパク質です。現在、神経系の発生機構をさらに理解するために、FKBP38の分子機構や生理機能の研究を続けています。
がんの微小環境とシグナル伝達
これまでに発がんに繋がる様々な遺伝子変異が知られていますが、その中にはmTORC1の異常活性化を誘導するものが多く含まれており、60%以上のがんにおいてmTORC1が異常活性化されていると言われています。mTORC1はたんぱく質リン酸化酵素であり、他の様々なたんぱく質をリン酸化することでがんを促進します。我々はmTORC1下流のシグナル伝達を解析する中で、脱リン酸化酵素であるPP2AB56の制御を介して転写因子であるFOXK1が脱リン酸化を受けて活性化し、その結果炎症性ケモカインであるCCL2の発現が上昇することが分かりました。このシグナル経路が腫瘍細胞で活性化した結果、腫瘍随伴マクロファージ (TAM) が腫瘍組織に浸潤し、がんの促進に寄与することがわかりました。【Nakatsumi, et al, Cell Reports, 2017; Nakatsumi, et al, Genes Cells, 2018】
現在われわれは、このシグナル伝達機構が他の疾患にも関わる可能性を考えて解析を進めています。また、mTORC1下流で引き起こされる様々なシグナル伝達がいかなる生理的意義を持つのかについても研究を行っています。
Publication
論文
- PDZD8-deficient mice manifest behavioral abnormalities related to emotion, cognition, and adaptation due to dyslipidemia in the brain.
Kurihara, Y, Kotone M, Nagi M, Shoji, H, Miyakawa, T, and *
Mol. Brain, 2023, 16: 11
- PDZD8-deficient mice accumulate cholesteryl esters in the brain as a result of impaired lipophagy.
Morita, K, Wada, M, , Nakatani, K, Matsumoto, Y, Hayashi, N, Yamahata, I, Mitsunari, K, Mukae, N, Takahashi, M, Izumi, Y, Bamba, T, and *
iScience, 2022, 16: 105612
- Protrudin regulates FAK activation, endothelial cell migration and angiogenesis.
Arora A, Kivelä AM, Wang L, Minkeviciene R, Taskinen JH, Zhang B, Koponen A, Sun J, , Zhou Y, Hotulainen P, Raiborg C, Olkkonen VM.
Cell. Mol. Life Sci., 2022, 79: 220
- Protrudin‑deficient mice manifest depression‑like behavior with abnormalities in activity, attention, and cued fear‑conditioning.
*, Shoji, H., Hashimoto, Y., Katagiri, H., Kobayashi, S., Manabe, T., Miyakawa, T., and Nakayama, K. I.
Mol. Brain, 2020, 13: 146-163
(*Corresponding author) - Protrudin and PDZD8 contribute to neuronal integrity by promoting lipid extraction required for endosome maturation.
*, Wada, M., Morita, K., Hayashi, N., Kunimatsu, R., Matsumoto, Y., Matsuzaki, F., Nakatsumi, H., Ohta, K., Tamura, Y., and Nakayama, K. I.
Nat. Commun., 2020, 11: 4567-4585
(*Corresponding author) - Nuclear-cytoplasmic shuttling protein PP2AB56 contributes to mTORC1-dependent dephosphorylation of FOXK1.
, Oka, T., Higa, T., , and Nakayama, K. I.
Genes Cells, 2018, 23: 599-605
- The autism-related protein CHD8 cooperates with C/EBPβ to regulate adipogenesis.
, Katayama, Y., Shiraishi, T., Oka, T., Sato, T., Suyama, M., Ohkawa, Y., Miyata, K., Oike, Y., , Nishiyama, M., and Nakayama, K. I.
Cell Reports, 2018, 23: 1988-2000
- TMEM55B contributes to lysosomal homeostasis and amino acid–induced mTORC1 activation.
Hashimoto, Y., *, and Nakayama, K. I.
Genes Cells, 2018, 23: 418-434
(*Corresponding author) - Noncanonical pathway for regulation of CCL2 expression by an mTORC1-FOXK1 axis promotes recruitment of tumor-associated macrophages.
, Matsumoto, M., and Nakayama, K. I.
Cell Reports, 2017, 21: 2471-2486
- SRRM4-dependent neuron-specific alternative splicing of protrudin transcripts regulates neurite outgrowth.
Ohnishi, T., *, and Nakayama, K. I.
Sci. Rep., 2017, 12: 709-719
(*Corresponding author) - Role of the ANKMY2-FKBP38 Axis in Regulation of the Sonic Hedgehog (Shh) Signaling Pathway.
Saita, S., *, Ishitani, T., Shimizu, N., and Nakayama, K. I.
J. Biol. Chem., 2014, 289: 25639-25654
(*Corresponding author) - Protrudin regulates endoplasmic reticulum morphology and function associated with the pathogenesis of hereditary spastic paraplegia.
Hashimoto, Y., *, Matsuzaki, F., Saita, S.,Ohnishi, T., and Nakayama, K. I.
J. Biol. Chem., 2014, 289: 12946-12961
(*Co-first and Corresponding author) - Identification and characterization of a neuron-specific isoform of protrudin.
Ohnishi, T., *, Hashimoto, Y., Saita, S., and Nakayama, K. I.
Genes Cells, 2014, 19: 97-111
(*Co-first and Corresponding author) - Selective escape of proteins from mitochondria during mitophagy.
Saita, S., *, and Nakayama, K. I.
Nat. Commun., 2013, 4: 1410-1423
(*Corresponding author) - Identification of CHD7S as a novel splicing variant of CHD7 with functions similar and antagonistic to those of the full-length CHD7L.
, Nishiyama, M., and Nakayama, K. I.
Genes Cells, 2012, 17:536-47
- Protrudin serves as an adaptor molecule that connects KIF5 and its cargoes in vesicular transport during process formation.
Matsuzaki, F., , Matsumoto, M., and Nakayama, K. I.
Mol. Biol. Cell., 2011, 22: 4602-4620
- Promotion of Neurite Extension by Protrudin Requires Its Interaction with Vesicle-associated Membrane Protein-associated Protein.
Saita S., , Natsume T.,Iemura S., Nakayama, K. I.
J. Biol. Chem., 2009, 284: 13766-13777
- Regulation of apoptosis and neurite extension by FKBP38 is required for neural tube formation in the mouse.
, Ogawa, M., Motoyama, J., Nakayama, K. I.
Genes Cells, 2008, 13:635-651
- Anchoring of the 26S proteasome to the organellar membrane by FKBP38.
Nakagawa T., , Iemura S., Natsume T., Nakayama, K. I.
Genes Cells, 2007, 12: 709-719
- Protrudin induces neurite formation by directional membrane trafficking.
, and Nakayama, K. I.
Science, 2006, 314: 818-821
- Interaction of presenilins with FKBP38 promotes apoptosis by reducing mitochondrial Bcl-2.
Wang, H. Q., Nakaya, Y., Du, Z., Yamane, T., , Kudo, T., Takeda, M., Takebayashi, K., Noda, Y., Nakayama, K. I. and Nishimura, M.
Hum. Mol. Genet., 2005, 14: 1889-1902
- Inherent calcineurin inhibitor FKBP38 targets Bcl-2 to mitochondria and inhibits apoptosis.
, and Nakayama, K. I.
Nat. Cell Biol., 2003, 5: 28-37
- Down-regulation of p27Kip1 expression is required for development and function of T cells.
Tsukiyama, T., Ishida, N., , Minamishima, Y., Hatakeyama, S., Kitagawa, M., Nakayama, K. and Nakayama, K. I.
J. Immunol., 2001, 166: 304-312
- Targeted disruption of Skp2 results in accumulation of cyclin E and p27Kip1, polyploidy and centrosome overduplication.
Nakayama, K., Nagahama, H., Minamishima, Y.A., Matsumoto, M., Nakamichi, I., Kitagawa, K., , Tsunematsu, R., Tsukiyama, T., Ishida, N., Kitagawa, M., Nakayama, K. I. and Hatakeyama, S.
EMBO J., 2000, 19: 2069-2081
- Molecular dissection of the interactions among IκBα, FWD1, and Skp1 required for ubiquitin-mediated proteolysis of IκBα.
Hattori, K., Hatakeyama, S., , Matsumoto, M. and Nakayama, K. I.
J. Biol. Chem., 1999, 274: 29641-29647
- Common pathway for the ubiquitination of IκBα, IκBβ, and IκBε mediated by the F-box protein FWD1.
, Hatakeyama, S., Hattori, K., Nakayama, K. and Nakayama, K. I.
J. Biol. Chem., 1999, 274: 28169-28174
- Down-regulation of p27Kip1 by two mechanisms, ubiquitin-mediated degradation and proteolytic processing.
, Harumiya, Y., Ishida, N., Hirai, A., Miyamoato, C., Hatakeyama, S., Nakayama, K. I. and Kitagawa, M.
J. Biol. Chem., 1999, 274: 13886-13893
- An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of β-catenin.
Kitagawa, M., Hatakeyama, S., , Matsumoto, M., Ishida, N., Hattori, K., Nakamichi, I., Kikuchi, A., Nakayama, K. I. and Nakayama, K.
EMBO J., 1999, 18: 2401-2410
- Ubiquitin-dependent degradation of IκBα is mediated by a ubiquitin ligase Skp1/Cul1/F-box protein FWD1.
Hatakeyama, S., Kitagawa, M., Nakayama, K., , Matsumoto, M., Hattori, K., Higashi, H., Nakano, H., Okumura, K., Onoe, K., Good, R.A. and Nakayama, K. I.
Proc. Natl. Acad. Sci. USA, 1999, 96: 3859-3863
- Mice lacking p27Kip1 display increased body size, multiple organ hyperplasia, retinal dysplasia, and pituitary tumors.
Nakayama, K., Ishida, N., , Inomata, A., Inoue, T., Shishido, N., Horii, I., Loh, D.Y. and Nakayama, K. I.
Cell, 1996, 85: 707-720
総説・著書
- Pathogenic contribution of cholesteryl ester accumulation in the brain to neurodegenerative disorders.
*
Neural Regeneration Research, 2024, 19(10):p 2099-2100
- Molecular machinery regulating organelle dynamics during axon growth and guidance.
* and Kamiguchi, H.
Seminars in Cell and Developmental Biology, 2022, S1084-9521(22)00058-1
(*Co-corresponding author) - Protrudin 複合体によるオルガネラ間コミュニケーションと神経機能
生化学(2021)93: 4,1‒10 - Lipid Transfer–Dependent Endosome Maturation Mediated by Protrudin
and PDZD8 in Neurons.
*
Frontiers in Cell and Developmental Biology, 2020, 8: 1-10
(*Corresponding author) - Roles of protrudin at interorganelle membrane contact sites
*
Proc Jpn Acad Ser B Phys Biol Sci., 2019, 95: 312-320
(*Corresponding author) - 膜コンタクト部位によるエンドソーム輸送の制御機構
細胞工学 (2015) 34: 1080-1085 - Mitochondria: FKBP38 and mitochondrial degradation.
* and Nakayama, K. I.
Int. J. Bioc. Cell Biol., 2014, 51: 19-22
(*Corresponding author) - マイトファジーにおける選択的タンパク質脱出の発見と機構解析
細田將太郎、*、中山敬一
細胞工学 (2013) 32: 582-583 (*Corresponding author) - 初期発生におけるCHD8 依存的なp53 の制御機構
, 西山正章, 中山敬一
BIO Clinica (2011) 26: 466-470 - FKBP38と相互作用するタンパク
生体の科学 (2008) 59: 548-552 - リサイクリング小胞輸送による神経突起形成の機構
蛋白質核酸酵素 (2008) 増刊号 メンブレントラフィックの奔流 53: 2202-2206 - 細胞内輸送におけるProtrudinの役割
生化学 (2007) 79: 794-796 - ユビキチン化酵素は異常タンパク質ハンターか?
タンパク質の一生集中マスター (2007) Up to date 21: 141 - HeLa細胞に神経突起が???
細胞工学 (2007) 26: 13 - 細胞膜の輸送調節による細胞の形づくり:神経突起形成のメカニズム
、中山敬一
細胞工学 (2007) 26: 62-63 - 膜輸送制御タンパク質Protrudinによる神経突起の形成機構
、中山敬一
実験医学 (2007) 25: 389-392 - ミトコンドリア・イムノフィリン:FKBP38によるアポトーシス抑制の最新研究
、中山敬一
日本臨床 (2004) 62: 405-412 - イムノフィリンFKBP38によるBcl-2のミトコンドリア局在化とアポトーシス抑制
、中山敬一
医学のあゆみ (2003) 205: 274-275 - カルシニューリン阻害分子FKBP38によるBcl-2のミトコンドリア局在化とアポトーシス抑制
、中山敬一
細胞工学 (2003) 22: 308-309 - Bcl-2をミトコンドリアに局在化させる分子
、中山敬一
実験医学 (2003) 21: 494-495 - CDKインヒビターp27KIP1の分解機構と癌
、中山敬一
Molecular Medicine (2000) 37 176-185 - p27KIP1における2つの分解機構
実験医学 (2000)18: 910-916
Seminar
プログレスレポート
各々の研究の進捗状況をプレゼンし、皆でディスカッションします。
週1回、ラボ全員参加。
ジャーナルクラブ
研究関連論文を担当者が背景を含めて解説し、皆でディスカッションします。
週1回、ラボ全員参加。
グループミーティング
各々の実験結果を報告し、ディスカッションします。
週1回、研究グループ別。
勉強会
細胞生物学や生化学や神経科学の基礎知識を体系的に勉強します。
随時。
